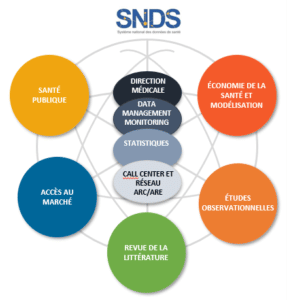
OPTIMARC, association à but lucratif, est née en Décembre 2000. C’est le premier regroupement d’Attachés de Recherche Clinique (ARCs) indépendants, en France.
Chaque membre du réseau conserve son autonomie et s’est engagé, à travers une charte de déontologie, dans une conception commune du métier et de ses exigences.
OPTIMARC forme une structure souple et réactive, au fonctionnement transparent, qui vous garantit un savoir-faire commun, une éthique et une homogénéité de ses pratiques.
OPTIMARC prend en charge toute ou une partie de votre étude.
Nous nous adaptons à vos besoins :
• Coordination de projet.
• Support pour soumissions réglementaires.
• Activités de monitoring.
• Assistance sur site / formations des équipes aux BPC.
• Mission de TECs : saisie, support aux visites patients etc.
Chaque ARC du réseau possède en moyenne une quinzaine d’années d’expérience en recherche clinique, dans toutes les phases du développement et dans toutes les pathologies. Les profils des ARCs sont variés et maximisent ainsi les chances, pour vous, de trouver la meilleure personne pour votre étude.
Notre couverture nationale vous permet de gagner en efficacité, pour le déploiement d’un projet, tout en réduisant les coûts de déplacement.